新闻动态
我国妇科肿瘤研究首篇 Cell:华中科技大提出新靶点 eTreg
发布时间:2024-07-10 13:47 浏览:9526次
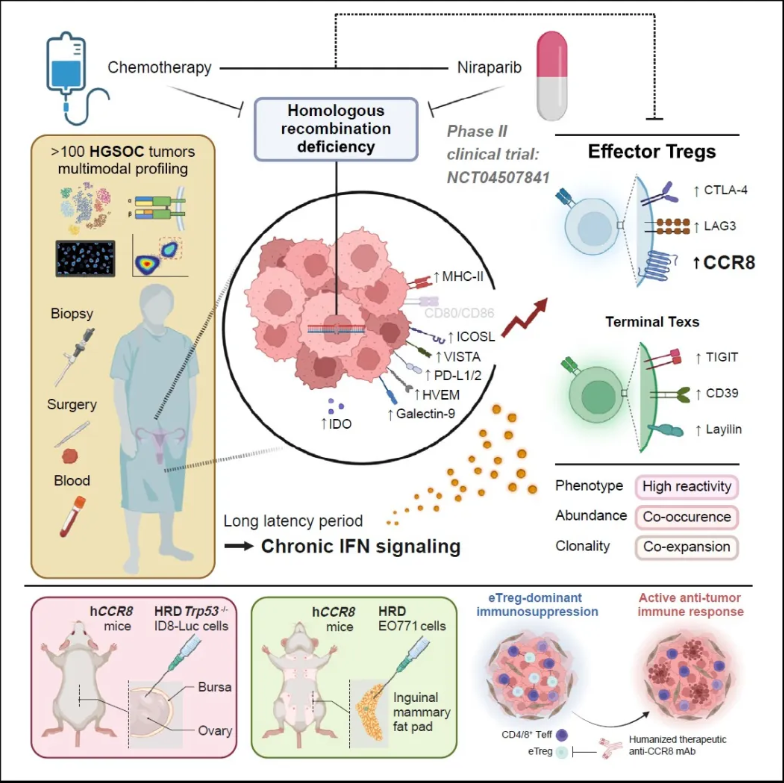
同源重组修复(homologous recombination repair,HRR)是细胞中 DNA 双链断裂后主要的修复方式。同源重组修复缺陷(homologous recombination deficiency,HRD)指细胞水平上的 HRR 功能障碍,通常由 HRR 相关基因胚系突变或体细胞突变以及表观遗传失调等诸多因素导致,常存在于卵巢癌、乳腺癌、胰腺导管癌、前列腺癌等多种恶性肿瘤中,在卵巢癌中 HRD 比例高达 50%。
多聚腺苷二磷酸核糖聚合酶(poly(ADP-ribose) polymerase,PARP)是应激条件下参与 DNA 修复的关键酶。作为 DNA 损伤的分子感受器,PARP 具有识别、结合到 DNA 断裂位置的功能,进而激活、催化受体蛋白的聚 ADP 核糖基化作用,参与 DNA 的修复过程。PARP 对于细胞的稳定和存活非常重要,PARP 失活则会加速细胞的不稳定。在临床上,多种 PARP 抑制剂已被批准用于卵巢癌、乳腺癌、前列腺癌和胰腺癌的治疗,主要是通过抑制 PARP 酶活性来杀死肿瘤细胞,尤其是在 HRD 的肿瘤中更具有显著疗效,这种基于 PARP 抑制剂的化学疗法被称为 PARPi 疗法。尽管最近的研究已经开始揭示 HRD 与人类癌症 (包括卵巢癌) 的肿瘤微环境(Tumor Microenvironment,TME)之间的相互作用,但解码 HRD 和 PARP 抑制对 TME 的相互作用仍然是重中之重。
2024 年 7 月 5 日,华中科技大学同济医学院附属同济医院高庆蕾教授、方勇教授、马丁院士联合德克萨斯大学 MD Anderson 癌症中心梁晗教授等团队在 Cell 发表研究。通过对 127 例高级别浆液性卵巢癌(High-Grade Serous Ovarian Cancer,HGSOC)样本进行单细胞和多模态分析,强调了以效应性 Treg 细胞为重点的治疗 HGSOC 和其他 HRD 相关肿瘤疾病的潜力,为临床上通过 PARP 抑制剂治疗卵巢癌提供指导。

绘制新辅助治疗下 HGSOC TME 的单细胞图谱
为了研究 HRD、新辅助治疗及其相互作用对 TME 的影响,研究人员在 II 期临床试验 (NCT04507841) 中招募了未接受治疗的新诊断为不可切除的 HGSOC 患者,为他们进行辅助性尼拉帕尼单药治疗 (neoadjuvant niraparib monotherapy,NANT) 或辅助性化疗(NACT)。治疗结果表明,NANT 是控制 HRD 合并 HGSOC 患者疾病进展的有效治疗选择。选择经 NANT 治疗前后的 24 对肿瘤样本作为单细胞 RNA 测序的队列,计算整合大于 62 万个细胞,并将他们划分为 10 种细胞类型进行后续分析。此外,研究人员还对患者的外周血进行了 scRNA-seq/TCR-seq、多重免疫组织化学 (mIHC)、流式细胞术分析和大量 TCR-seq,最终形成了大规模、多模态的高质量数据集,以阐明肿瘤的 HRD 状态以及治疗如何影响卵巢癌的 TME。
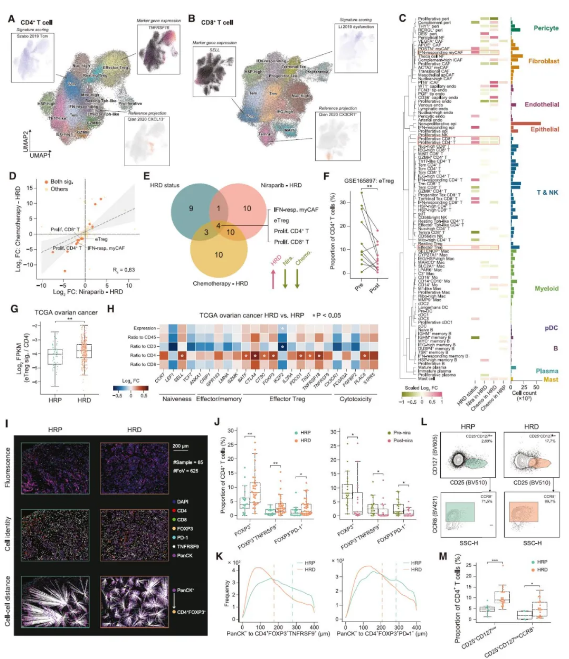
新辅助治疗优先抑制 HRD HGSOC TME 中的 eTregs 细胞
治疗前后究竟是哪群/类细胞发生了变化呢?通过分析比较测序结果,研究人员发现干扰素应答的 myCAFs,效应调节性 T 细胞 (eTregs) 和增殖性 CD4+/CD8+ T 细胞在治疗初期 HRD TME 中丰度较高,而在治疗后 HRD 肿瘤中丰度降低。鉴于 Treg 是数据集中最丰富的 T 细胞群,且 eTreg 亚群具有免疫抑制功能,后续则主要对 eTreg 细胞群进行分析验证。通过对已发表 scRNA-seq 队列分析、TCGA 数据库分析、免疫组化检测以及流式细胞术分析,表明新辅助治疗后最显著的变化是 HRD 富集的 eTregs 明显减少。进一步分析表明 HRD 和新辅助疗法导致肿瘤 TME 中 eTregs 通过与 CD4+ T 细胞增殖池不断交换,具有强大但受肿瘤限制的自我扩张能力,而同样由肿瘤诱导的 Texs 则来自多个效应 CD8+ T 细胞子集。
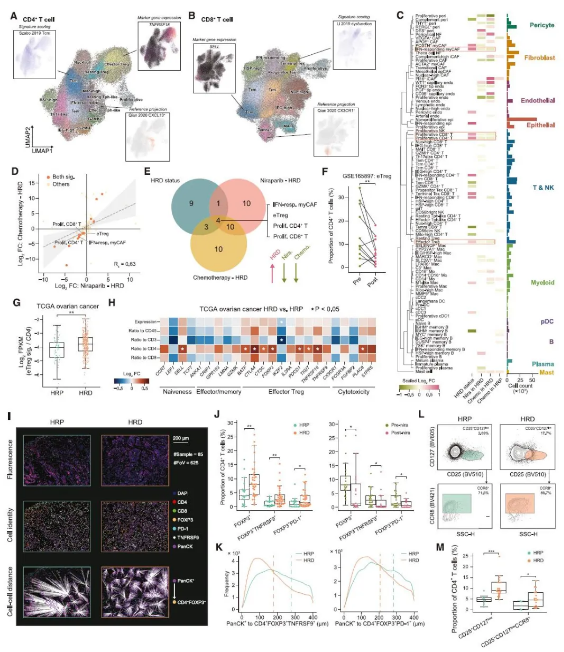
TME 干扰素信号的变化与 HRD 相关的 eTreg 富集呈正相关
进一步地,研究人员发现治疗后 TME 中发生明显数量变化的 eTregs 和 Texs 中均以激活 IFN 信号为标志。通过比较抗原呈递系统表达水平,发现 IFN 通过激活 MHC I 类和 MHC II 类基因的主调控因子 CITA 和 CIITA 来上调 MHC I 类和 MHC II 类基因表达的作用,干扰素诱导的 HRD 肿瘤细胞中 MHC II 类表达可能有助于 eTregs 富集,这一结论在多种卵巢癌和乳腺癌细胞系中得到验证。
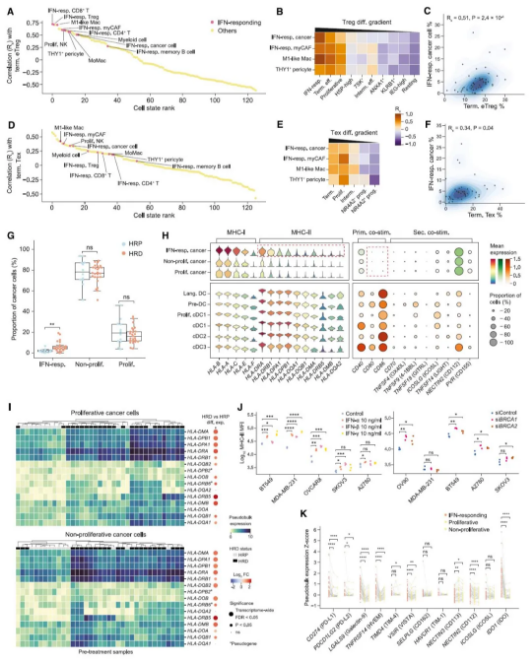
联合靶向 PARP 和 eTregs 治疗 HRD HGSOC 肿瘤具有较好疗效
HRD 肿瘤治疗后 eTregs 显著减少可以指导临床治疗吗?研究人员利用人源化治疗性单克隆抗体 ZL-1218(目前已在 I 期临床试验中用于治疗晚期实体瘤)靶向 eTreg 标记物 CCR8。为了评估其疗效,通过向人源化 ccr8 (hCCR8) 小鼠中注入带有 CRISPR 编辑的 Trp53 和 Brca1 的 ID8-Luc 细胞,构建了原位 HGSOC 小鼠模型,与肿瘤患者中表现一致,HRD trp53 缺失的小鼠肿瘤中 eTreg 和末端 Texs 的比例明显高于 HRP 对应的肿瘤。接着,在移植 2 周后给荷瘤小鼠施用 PARP 抑制剂尼拉帕尼和/或 CCR8 单抗,虽然单独使用尼拉帕尼或 CCR8 单抗可以减缓肿瘤进展,但它们联合使用显示出更明显的抑制作用。重要的是,出血性腹水的发展作为卵巢癌的致命标志被联合治疗显著遏制。其他 Tregs 消耗疗法也显示出与 PARP 抑制相结合类似的抗肿瘤效果。
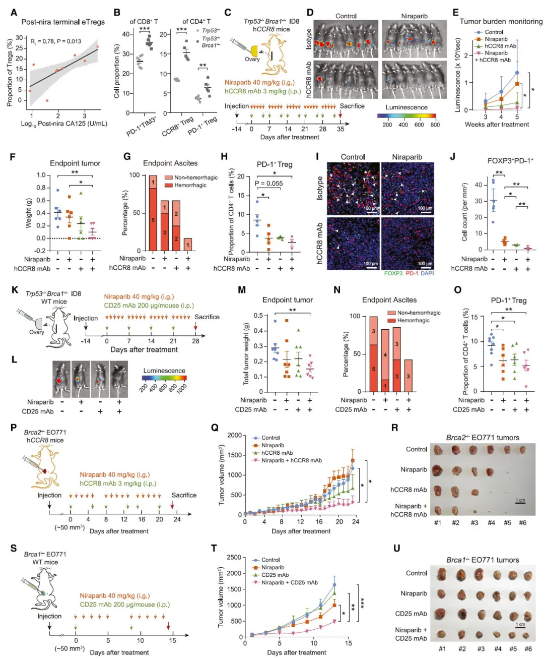
总体而言,本项研究通过对治疗前后的 HGSOC 肿瘤样本进行单细胞基因表达和 T 细胞受体多模态数据分析,发现效应调节性 T 细胞 (eTregs) 与 Texs 细胞共同作为 HRD 和新辅助治疗的关键应答者,干扰素信号通过上调 MHC-II 类分子等诱导 Tregs 和 Texs 富集。此外,在有或没有 PARP 抑制的 HRD 小鼠模型中,消耗 eTreg 可显著抑制肿瘤生长而无明显毒性,这项工作突出了以 eTreg 为靶点的治疗 HGSOC 和其他 HRD 相关肿瘤的潜力。
转载自丁香学术

