科技动态
治疗卵巢癌的潜在新策略
发布时间:2024-03-12 12:53 浏览:4843次
腹腔热灌注化疗在卵巢癌中的作用仍存在争议,其阻碍因素是对热诱导的肿瘤细胞变化的了解有限。这限制了开发以腹腔热灌注疗法(HIPET)为锚定的有效联合策略。
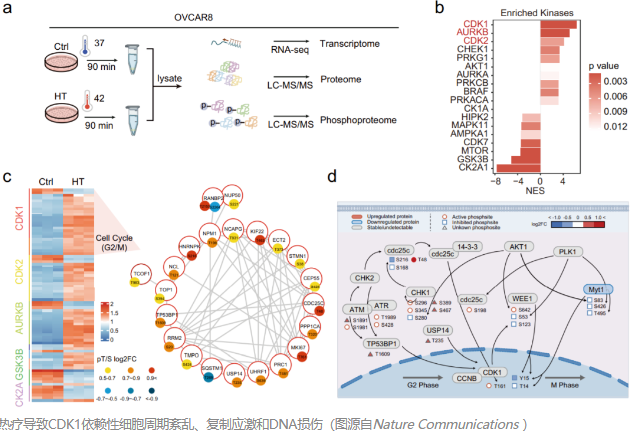
2024年3月7日,我中心教授孙朝阳、陈刚及中山大学李晶共同通讯在Nature Communications 发表题为“Comprehensive multi-omics analysis reveals WEE1 as a synergistic lethal target with hyperthermia through CDK1 super-activation”的研究论文,本研究对热疗下的卵巢癌细胞进行了全面的多组学研究,揭示了一个独特的分子全景图,主要特征是快速的蛋白质磷酸化变化。基于磷酸化特征,研究确定CDK1激酶在体温过高期间过度激活,从而影响全球信号传导景观。
该研究观察到动态、可逆的CDK1活性,导致复制停滞和体温过高后的早期有丝分裂进入。随后的药物筛选显示,WEE1抑制与热疗协同破坏癌细胞。内部开发的小型化设备证实了热疗和WEE1抑制剂组合可显着减少体内肿瘤。这些发现为HIPET提供了更多的见解,详细说明了热疗的分子机制,并确定了靶向治疗的精确药物组合。这项研究推动了精准腹腔热灌注治疗的概念,凸显了其治疗卵巢癌的潜力。
上皮性卵巢癌(EOC)通常处于晚期,仍然是最致命的妇科癌症。全世界每年有230,000名妇女被诊断出来,150,000名妇女将死于EOC。导致EOC高死亡率的主要因素之一是初步诊断时的晚期,伴有广泛的腹膜转移(PM)和缺乏对晚期疾病的有效治疗。晚期EOC的初始治疗需要专家级的多学科护理,包括手术和辅助治疗。主要治疗是“最佳手术”,留下最小的残留病灶。虽然大多数晚期疾病的女性进入缓解期,但大多数患者会出现疾病复发,并最终对标准护理化疗产生耐药性并屈服于疾病。
一项精心设计的荷兰随机试验(OVIHIPEC 1)显示腹腔热灌注化疗(HIPEC)结合了热疗(HT)和腹腔内化疗,可显著改善接受最佳间期肿瘤减灭术的卵巢癌患者的OS(45.7个月vs. 33.9个月)。然而,在其他随机对照试验中,HIPEC的获益水平相互矛盾或不一致。此外,HIPEC中“HT”成分的作用机制仍不清楚。了解HT如何产生有益作用有可能揭示获得性弱点,从而优化以腹腔热灌注疗法(HIPET)为锚定的联合策略。全局转录研究为 HT 诱导的分子通路和信号转导网络提供了重要的生物学见解。然而,转录水平并不总是真实地反映蛋白质丰度,尤其是在细胞状态因环境变化而转变时,部分原因是转录和翻译之间的时间延迟。此外,翻译后调控,尤其是磷酸化,在调节蛋白质功能和信号传导以快速适应细胞应激方面起着至关重要的作用,但从 RNA 水平预测不佳。然而,仍然缺乏对HT引发的信号转导途径和后续功能后果的系统和无偏见的分析。该研究展示了卵巢癌细胞中HT诱导的转录,基于TMT的全蛋白质组和磷酸化蛋白质组变化的全局分析。多层整合分析说明了HT诱导的分子和信号重编程的多组学全景。大部分由HT引起的蛋白质变化并不反映在mRNA水平,提示HT对蛋白质进行广泛的转录后调控,这验证了蛋白质组学分析的价值。正如预测的那样,磷酸化蛋白质组学能更好地反映HT过程中的早期分子事件。基于磷酸化标记,研究确定细胞周期蛋白依赖激酶1 (CDK1)在HT过程中被过度激活,并负责观察到的全球信号通路。分子和功能实验证明了HT后CDK1活性的动态和可逆的变化,随后的复制停滞和有丝分裂的破坏。此外,通过数据驱动的药物筛选,研究发现了合成致死效应,并进一步建立了HT联合WEE1抑制的最佳组合策略和治疗窗口。通过自制的小型、精简和可重复的模拟临床治疗方案的装置,研究验证了HIPET联合WEE1抑制剂(WEE1i)对小鼠卵巢癌PM的体内疗效,表明联合WEE1i可能是一种有吸引力的HIPET治疗策略。热疗导致CDK1依赖性细胞周期紊乱、复制应激和DNA损伤(图源自Nature Communications )总之,该研究对HT后的卵巢癌细胞进行了全面的多组学研究。多层整合分析确定了该细胞对HT抑制的易感性,数据驱动的药物筛选确定WEE1是HT杀伤肿瘤细胞的合成致死靶点。通过自制的模拟临床治疗方案的HIPET装置,研究验证了结合WEE1i的HIPET治疗策略,有望从传统的化疗相关HIPET (HIPEC)过渡到更新的P-HIPET时代。考虑到WEE1i AZD1775 (adavosertib)目前正在进行多项2期临床试验(http://www.clinicaltrials.gov),因此应优先在临床环境中评估HIPET和WEE1i,以使患者获益最大化。
【转载 iMedicines】